肿瘤新生抗原
(一) 肿瘤的发生与治疗
人类个体漫长的生命过程中,除了遗传携带的DNA突变外,如强紫外线、某些化学试剂、病毒感染等等都有可能造成个体某些细胞的DNA突变。随着生命的旅程,这些DNA突变将逐渐累积,也就有可能演变为肿瘤。
传统的肿瘤治疗方法包括手术治疗、放疗、化疗以及靶向药疗法四类。然而这四种方法均有各自的局限性:手术切除无法解决微小病灶以及转移性病灶的问题,且手术效果取决于患者肿瘤组织形态以及医生经验;放疗、化疗对于身体正常组织器官有较大的毒副作用;靶向药容易产生耐药性等问题。
肿瘤免疫疗法是新一代的抗肿瘤疗法,是指利用机体自身的免疫系统来清楚肿瘤细胞。其基本思路是通过解除肿瘤微环境的免疫抑制、提高树突状细胞的抗原呈递功能及促进产生保护性T细胞等方式激活人体自身的免疫系统,从而达到识别和杀伤癌细胞的目的。
(二) 肿瘤新生抗原是现有免疫疗法中最为有效的biomarker
无论是传统疗法还是免疫疗法,基本点仍然是如何区分正常细胞与肿瘤细胞,然后才是去考虑如何清除肿瘤细胞。新生抗原(Neoantigen) 是一类肿瘤特异性抗原,它是由于基因突变、病毒感染、基因重排等原因产生的,并被MHC分子递呈至肿瘤细胞表面,从而激活免疫系统的异常多肽。
新生抗原的产生过程如图1。突变可以通过转录成mRNA并经过核糖体翻译后形成长肽链,进一步被蛋白酶体水解,形成6-30个氨基酸不等的抗原肽,内质网表面的抗原加工相关转运体(TAP)可选择性地将部分抗原肽转移至内质网腔内。抗原肽在内质网中与MHC I类分子形成复合物,pMHC复合物通过小囊泡运送至细胞膜附近,最终通过膜融合的方式锚定于细胞表面,供CD8+ T细胞识别。需要注意的是,MHC I类分子在递呈抗原肽的同时也会递呈体细胞内源性的小肽,因此,尽管肿瘤新生抗原已被证明普遍存在,但有可能在不同的肿瘤细胞表面,被递呈的肿瘤新生抗原数量及种类均有较大的差别。
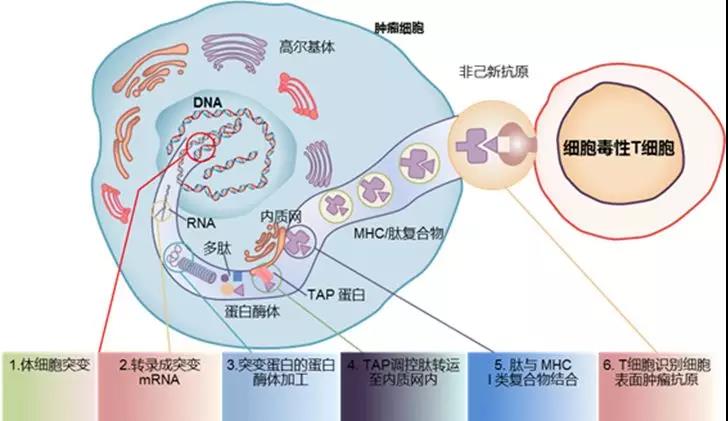
图1. 肿瘤新生抗原合成路径(来源:CCR Review)
可以看出,肿瘤新生抗原的体内合成是一个多步骤的复杂过程。因此,从肿瘤细胞中的基因突变到肿瘤新生抗原的形成,至少需要考虑突变的基因及突变类型、蛋白酶体降解情况、TAP转运可能性以及抗原肽与MHC亲和力等因素。此外,为了实现免疫逃逸,肿瘤可能会下调抗原递呈相关信号通路的基因表达,比如删除MHC-I中与抗原肽直接互作的HLA分子基因等。因此,上述任意的限制都有可能造成新生抗原肽递呈的失败。2014年《Nature》的一篇文章曾以M38肿瘤细胞系为对象,研究体细胞基因突变与肿瘤新生抗原的数量关系。可以看出,对于外显子组中的28439个突变,可被质谱检测出的肿瘤新生抗原仅有7个,其中被证明有较强免疫原性的新生抗原为3个。即便考虑到质谱的灵敏性限制了新生抗原的检出,真实存在的肿瘤新生抗原数量也十分有限。
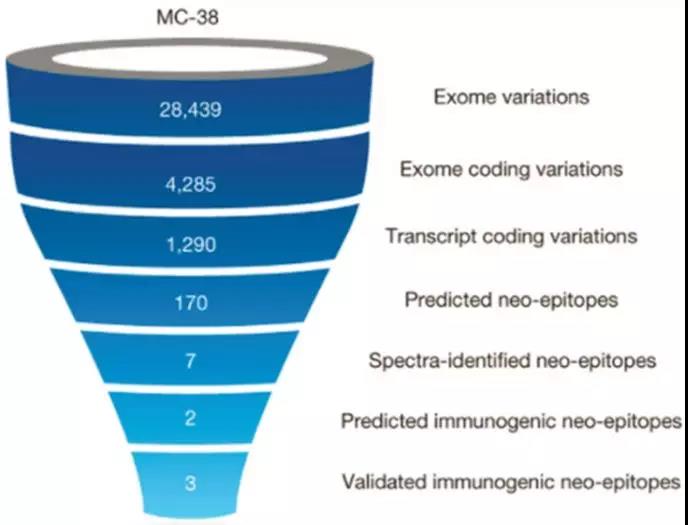
图2. 肿瘤体细胞突变箭头→肿瘤新生抗原中的数量变化(来源:Nature)
(三) 肿瘤新生抗原的应用前景
<1> 免疫疗法体外诊断
免疫检查点抑制剂、过继性细胞疗法和肿瘤疫苗是当前临床上已被证明的免疫疗法。在研发和临床应用时,患者首先需要接受伴随诊断(IVD的一种)。这是一个极为重要的环节,它决定了患者更加适合的治疗方案、初步判断所使用的药物不良反应和最大疗效。伴随诊断的需求在肿瘤治疗的靶向药阶段就已经逐渐出现,但靶向药由于其作用机制较为明确,伴随诊断仅需对某一个/几个特定的基因类型进行检测,较为便捷因而相对成熟。肿瘤免疫疗法的伴随诊断涉及到免疫过程的多个阶段,其中的机制复杂交错,大多数情况下在科研上仍没有被充分解释,这对伴随诊断的准确性带来了极大的挑战。从概念上来说,肿瘤免疫治疗的核心在于帮助免疫系统更好地识别肿瘤这一异于自体正常情况的组织,解除肿瘤微环境的免疫抑制、加强肿瘤杀伤能力。因此,新生抗原作为肿瘤中最为特异性的存在,是起始肿瘤免疫的瓶颈,也是IVD能够做出更精确评估的核心所在。
以免疫检查点抑制剂疗法(ICIs)为例,其基本假设为:患者首先已经存在抗肿瘤的T细胞反应,PD-1/PD-L1抗体阻断剂疗法才能进一步发挥作用。肿瘤浸润性T细胞首先通过TCR识别肿瘤新生抗原并部分激活,上调PD-1表达并释放IFN-γ, IFN-γ则造成肿瘤细胞免疫相关蛋白如MHC-I类分子表达的上调,加强对于肿瘤新生抗原的递呈,增强免疫原性。同时肿瘤细胞应对IFN-γ亦会上调PD-L1的表达,通过PD-1/PD-L1抑制性信号通路实现免疫赦免。PD-(L)1抗体阻断了抑制性信号,因此浸润性T细胞可以发挥肿瘤杀伤的作用。可以看出,这一治疗机制的第一步在于免疫系统通过肿瘤新生抗原对癌细胞进行识别。
<2> 体外诊断的biomarker
目前对于PD-1/PD-L1用药的伴随诊断包括肿瘤PD-L1表达情况、肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)、HLA分型、肿瘤新生抗原负荷(TNB)以及其他科研中明确揭示的生理或病理功能的相关基因。其中,PD-L1的表达通过免疫组化(IHC)实现,其他biomarkers大多数通过基于杂交-捕获的NGS进行分析。在多种biomarkers中,PD-L1表达和MSI/dMMR(基因错配修复功能缺陷)状态已被FDA批准用于PD-(L)1疗法的伴随诊断,其他仍处于研究阶段。
2017年美国FDA批准了PD-1抗体pembrolizumab 用于治疗微卫星不稳定性高/错配修复缺陷(MSI-H/dMMR)的实体瘤患者,是FDA首次批准的不依照肿瘤来源,而是biomarker进行区分的抗肿瘤疗法。对dMMR的检测可通过对特定的DNA错配修复蛋白的IHC实现,MSI-H可通过PCR以及NGS进行检测。由于dMMR会造成MSI-H,因此将二者看作同一个指标。
肿瘤突变负荷(TMB)是近年来biomarker研究的热点,其最直观的定义是肿瘤细胞外显子中每兆碱基对(Mbp)中出现的体细胞突变个数。其作为biomarker的基本假设是肿瘤基因组突变数量越多,形成的突变多肽被呈递至细胞表面成为肿瘤新生抗原的可能性就越大,因而更能从ICIs中获益。然而如之前所述,并不是所有基因的突变都与肿瘤新生抗原直接相关,另外,不同突变类型(SNV、Indels等)所对应的免疫原性也不尽相同。如果不加偏向性地检测尽可能多的基因的突变情况,除了大大增加成本之外,还有可能导致数据质量的退化,使得真正有意义的突变被淹没在众多数据当中,如果检测机构对假阳性数据进行过滤的算法并未得到很好的training,则很容易做出错误的判断。此外,对于TMB-H/M/L的cutoff值设定,在不同机构当中也不尽相同,一些认为TMB ≥25个/Mb为TMB-H;同时有一些机构对于肿瘤新生抗原和基因突变相关性的理解更强,数据检测及分析灵敏度更高,也会将TMB≥15个/Mb甚至更低的值定义为TMB-H。目前对于TMB具体检测基因类型以及cutoff值仍没有统一的定义,但可以推知的是,由于TMB实质上是肿瘤新生抗原的替代标志物,因此对肿瘤新生抗原有更深刻理解的机构才能在进一步控制成本的前提下增加TMB作为biomarker的指导意义。
HLA是一种在科研上得到相对明确验证的biomarker。在HLA-I类分子中,HLA直接参与抗原肽的结合与递呈。因此患者自身HLA的杂合性越高,能够递呈的肿瘤新生抗原种类越多。如果肿瘤细胞通过一系列突变删除了HLA相关基因(loss of heterozygosity, LOH)或者出现了MHC-I组成成分β2微球蛋白的缺陷甚至缺失,能够递呈的抗原肽则大大降低(如图?)。目前限制HLA作为biomarker进行推广应用的原因在于HLA基因是人群中多态性最强的基因(超过10000多种等位基因),如何提高探针捕获不同HLA等位基因的成功率是其中的关键点。
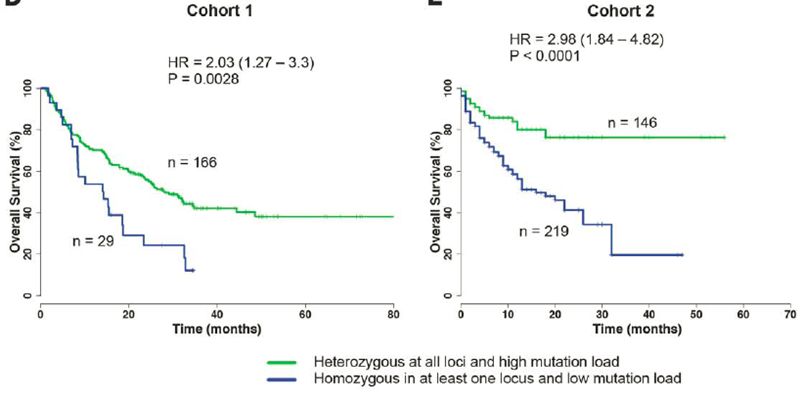
图3. 自身HLA杂合,TMB-H患者更容易从ICI疗法中获益(来源:Science)
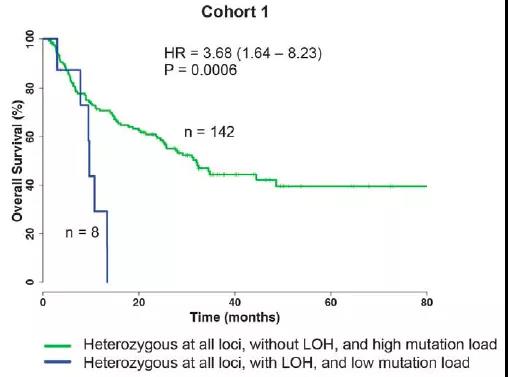
图4. 肿瘤HLA-LOH及TMB-L的患者对ICI疗法响应降低(来源:Science)
研究表明,PD-L1表达情况与TMB这两种biomarker之间并没有明显相关性。PD-L1表达水平反映的是T细胞炎症性的肿瘤微环境,而包括TMB、TNB、MSI和HLA在内的多种biomarker,针对的是肿瘤新生抗原形成的可能性。目前越来越多的研究显示,在ICI研发及诊疗的过程中,需要运用多种biomarkers进行综合评估以提高伴随诊断的准确性。其中,对于肿瘤新生抗原的进一步理解将极大地提升ICI以及ICI-combo疗法伴随诊断的准确性
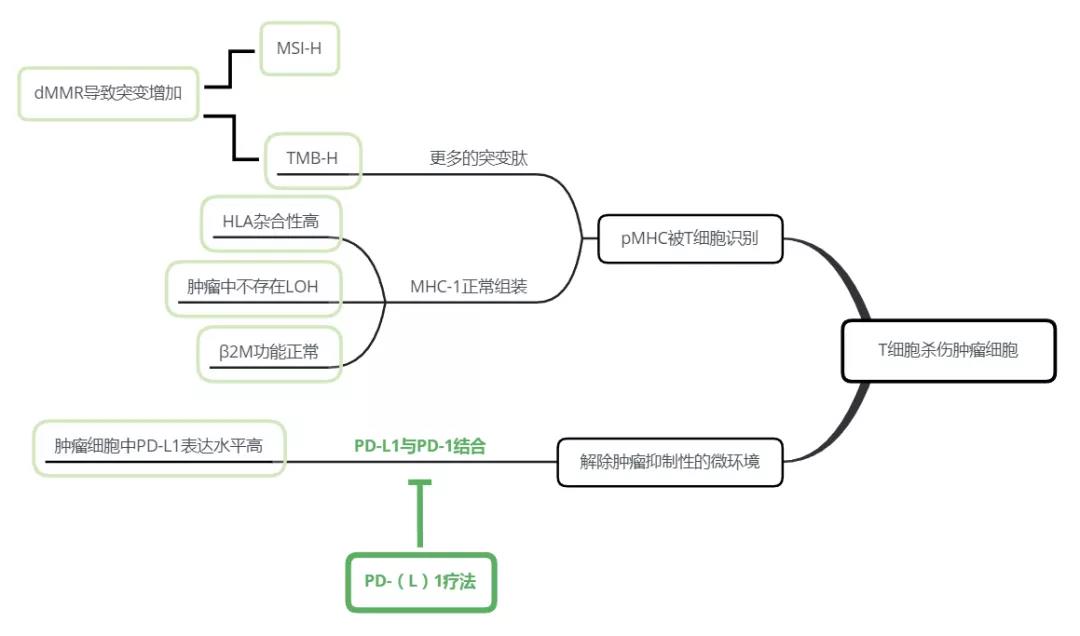
图5. ICIs伴随诊断中的biomarkers及其指征
<3> TCR-T和肿瘤疫苗
肿瘤新生抗原可以作为个性化TCR-T及肿瘤疫苗的靶点。例如基于新生抗原,设计并制备个体化抗肿瘤疫苗注射剂,通过皮下注射激活患者体内特异的T细胞,使患者自身免疫系统能够有效识别、杀灭肿瘤细胞,以及预防肿瘤的复发。然而,TCR-T和肿瘤疫苗要求肿瘤新生抗原的精准预测。较强的免疫原性是保证疗效的重要因素,这对肿瘤新生抗原的预测提出了远高于ICI伴随诊断的精度要求。依据现有的研究结果,肿瘤新生抗原作为靶点的能力仍然需进一步提高。对于肿瘤疫苗而言,如何同时选取多新生抗原表位共同使用以增加疫苗的免疫刺激性,疫苗是否能够驱动足够的T细胞发生激活,而激活后的T细胞是否能一定转移至肿瘤并行使杀伤作用,都需要进一步的回答。对于TIR及TCR-T疗法,如何更高效地鉴定新生抗原特异性TCR,是否需要工程化改造TCR进一步增加对肿瘤新生抗原的亲和力,同时平衡好药效及副作用之间的关系,同样需要科研及临床实践的不断累积。理论上来说,对于肿瘤新生抗原,尤其是强免疫原性肿瘤新生抗原的预测,会大大减少下游验证成本,同时增加对应疗法的效果,提高后续药物在早期研发阶段的成功率。
原文作者: Billy & Barney
原文链接: https://liangbilin.github.io/2020/02/18/BIlly--肿瘤新生抗原/
版权声明: 转载请注明出处(必须保留作者署名及链接)